عناصر موجود در بدن انسان
اگه بدن انسان را در نظر بگیریم متوجه می شویم که از عنصر های زیادی درست شده که اگه مقدار هر کدوم رو اندازه بگیریم می تونیم بگیم که با این ها چه چیزهایی می شه درست کرد و میشه یه قیمتی هم برای انسان در نظر گرفت
اکسیژن : ۵/۴۵ کیلوگرم
کربن : ۶/۱۲ کیلوگرم
پتاسیم : ۲۱۴/۰ کیلوگرم
آهن : ۳ گرم
منیزیم : ۳ گرم
هیدروژن : ۷ کیلوگرم
نیتروژن :۱/۲ کیلوگرم
کلر : ۱ کیلوگرم
مواد معدنی دیگر : ۲ گرم
که با این ها ما می تونیم این مواد را درست کنیم:
۵ کیلوگرم شمع - ۶۵ جین مداد ذغالی سیاه - ۷ عدد میخ - ۸۲۰۰۰ چوب کبریت - ۲۰ قاشق نمک - ۸۵۰ عدد حبه قند - ۴۲ لیتر آب
حالا اگه بخواهیم با این مواد بدست آمده یه قیمتی بزنیم می تونیم بگیم : ۱۱ هزار تومان
پیوند پی
اوربیتالهای مولکولی حاصل از ترکیب اوربیتال های اتمی (2P) ، کمی پیچیدهترند. سه اوربیتال (2P) هر اتم ، در امتداد محورهای مختصات دکارتی (X ، Y ، Z ) قرار دارند. اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتمها در امتداد یکی از این محورها مثلا (X) در نظر بگیرییم، دو اوربیتال اتمی (Px) سر به سر به یکدیگر نزدیک میشوند و در نتیجه همپوشانی ، دو اوربیتال مولکولی پیوندی (б 2P) ، و ضد پیوندی б* 2P را به وجود میآورند.تعریف پیوند پی
پیوند کووالانسی که تراکم الکترونی آن در دو ناحیه بالا و پایین محور متصل کننده دو اتم پیوند بیشتر است، پیوند پی (п) نامیده میشود.
اوربیتال پیوندی مولکولی پی (π) و ضد پیوندی پی п*
در تشکیل یک مولکول دو اتمی ، دو اوربیتال اتمی (Pz) از پهلو به هم نزدیک میشوند و دو اوربیتال مولکولی ، یکی اوربیتال پیوندی پی (п) و دیگری اوربیتال مولکولی ضد پیوندی پی п* را به وجود میآورند. اوربیتالهای (п) نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال (п) میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال (п*) ، به هم نگه داشتن مولکول است. اوربیتال п* ، در ناحیه بین دو هسته ، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال п* جدا کردن دو اتم از یکدیگر است. اوربیتالهای اتمی (Py) نیز از پهلو به هم نزدیک میشوند. این دو اوربیتال اتمی نیز یک مجموعه دوتایی اوربیتال مولکولی п و п* به وجود میآورند که نسبت به مجموعه اول عمود است.
انرژی اوربیتالهای п 2P و п* 2P
دو اوربیتال п2P با یکدیگر و دو اوربیتال п* 2P با یکدیگر هم انرژی هستند. بنابراین ، شش اوربیتال مولکولی از دو مجموعه سه تایی 2P به وجود میآید یک اوربیتال σ 2P ، یک اوربیتال σ* 2P ، دو اوربیتال п 2P و دو اوربیتال п* 2P. این شش اوربیتال به همراه دو اوربیتال از دو اوربیتال اتمی 2S ، مجموعا هشت اوربیتال مولکولی را تشکیل میدهند که از اوربیتالهای اتمی n=2 مربوط به دو اتم به دست میآیند.
تعریف انرژی اوربیتال مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و نیز به میزان و نوع همپوشانی اوربیتال های اتمی ، در هنگام تشکیل آن ، بستگی دارد.مقایسه انرژیσ 2P وп 2P
چون میزان همپوشانی اوربیتالهای 2P در تشکیل اوربیتال مولکولی б 2P بیشتر از همپوشانی آنها برای به وجود آوردن اوربیتال مولکولی п 2P است. اوربیتال σ 2P انرژی کمتری از دو اوربیتال مولکولی هم تراز п 2P دارد. اوربیتالهای ضد پیوندی از هر نوع ، نمایند همان قدر افزایش انرژی سیستم است که اوربیتال پیوندی از همان نوع ، از انرژی سیستم میکاهد.نیروی واندروالسی
اولین بار "یوهانس واندروالس" در سال 1873 وجود نیروهای جاذبه بین مولکولی در میان مولکولهای گاز را مطرح کردز به نظر واندروالس مجموع این نیروها هستند که مقدار انحراف یک گاز حقیقی از گاز ایده آل را معین میکنند توضیح منشأ این نیروهای بین مولکولی توسط "فرتینر لاندن" در 1930 پیشنهاد شد. امروزه نیروهای بین مولکولی را بصورت عام نیروهای واندروالس و نیروهای پراکندگی بین مولکولهای غیرقطبی را نیروهای لاندن مینامند.
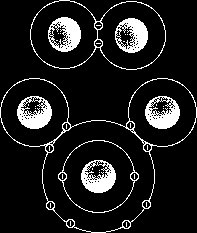
انواع نیروهای واندروالسی
نیروهای دوقطبی - دوقطبی
این نیروها بین مولکولهای قطبی دیده میشوند. این مولکولها دارای دو قطبی های دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی بوجود میآید.با توجه به مقادیر الکترونگاتیوی اتمها در یک مولکول دو اتمی میتوان میزان قطبیت مولکول و جهتگیری قطبهای مثبت و منفی را پیش بینی کرد، اما پیش بینی قطبیت مولکولهای چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترونهای غیر مشترک باشد.
پیوند هیدروژنی
پیوند هیدروژنی نوعی نیروی بین مولکولی میباشد که در آن ، بین اتم هیدروژن از یک مولکول با اتمهای الکترونگاتیو F و O و N از مولکول دیگر جاذبهای بوجود میآید که به پیوند هیدروژنی معروف است. پیوند هیدروژنی فقط بین ترکیبات دارای H و O و N و F وجود دارد، یعنی در این ترکیبات ، هیدروژن بعنوان پلی بین دو اتم الکترونگاتیو عمل میکند. انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود 1 تا 10 کیلوکالری متغیر است.اگرچه پیوندهای هیدروژنی ضعیفتر از پیوندهای کووالانسی میباشد، اما در میان نیروهای بین مولکولی قویترین آنها بشمار میرود. پیوندهای هیدروژنی نقش موثری در ساختار مواد مهم بیولوژیکی شامل پیوندهای N - H و O - H و تعیین خواص آنها دارد. شکل هندسی پروتئینها و نوکلئیک اسیدها که مولکولهای آلی دارای زنجیر بلند هستند با پیوند هیدروژنی میان گروههای N - H یک زنجیر و گروه C = O زنجیر مجاور تثبیت میشود.
نیروهای لاندن (پراکندگی)
مولکولهای غیرقطبی ، دو قطبی دائمی ندارند ولی با وجود این ، تمام مواد غیرقطبی را میتوان مایع کرد. از اینرو ، علاوه بر نیروی دوقطبی - دوقطبی ، باید نوع دیگری از نیروی بین مولکولی وجود داشته باشد. وجود نیروهای پراکندگی در مولکولها بعنوان یک اصل پذیرفته شدهاست. تصور میشود این نیروها ناشی از حرکت الکترونها باشد. در یک لحظه از زمان ، ابر الکترونی یک مولکول بنحوی تغییر شکل میدهد که یک دوقطبی لحظهای بوجود میآید که در آن ، قسمتی از مولکول به مقدار بسیار کم منفیتر از قسمتهای دیگر است و در لحظه بعد ، بعلت حرکت الکترونها جهت دوقطبی لحظهای تغییر میکند.اثر این دوقبیهای لحظهای در طول زمان بسیار کوتاه ، یکدیگر را حذف میکنند، بصورتی که مولکول غیر قطبی فاقد دوقطبی دائمی میشود. ولی دوقطبیهای مواج لحظهای یک مولکول ، دوقطبیهای نظیر خود را در مولکولهای مجاور القا میکنند و حرکت همزمان الکترونهای مولکولهای مجاور باعث ایجاد نیروی جاذبه بین این دو قطبیهای لحظهای ، نیروی لاندن را تشکیل میدهند. نیروی لاندن بین مولکولهای قطبی هم وجود دارد، اما تنها نیروی بین مولکولی موجود در مولکولهای غیرقطبی است.
اثر کامپتون
اطلاعات اولیه
زمانی که یک پرتو نور بر روی مادهای میتابد، انواع برهمکنشهای مختلف بین فوتون و ماده متصور است (اثر تابش بر ماده). از جمله این برهمکنشها ، میتوان به اثر کامپتون اشاره کرد. میتوان گفت که این اثر مستقیمترین گواه برخاصیت ذره ای نور میباشد. در زندگی روزمره خود بارها این اثر را مشاهده میکنیم. به عنوان مثال ، نور خورشید بعد از تابش با عناصر موجود در جو زمین اندرکنش انجام میدهد.تاریخچه
پایه محکم دیگر برایفرضیه کوانتومی نور ، توسط فیزیکدان آمریکایی ،آرتور کامپتون (Compton) ، در سال 1992 فراهم شد. کامپتون نوازنده گیتار ، قهرمان تنیس و محقق نامداری در بررسی پرتوی کیهانی بود. کامپتون دانشمند تجربیکار متعصبی بود که میل داشت برخورد کوانتومهای نور و الکترون ها را ، عینا مانند برخورد گلولههای عاج بر روی میز بیلیارد ، تصور و تجسم کند. اثر کامپتون مستقیمترین گواه بر طبیعت ذرهای تابش است.نظریه کلاسیک پراکندگی امواج الکترومغناطیسی
وقتی امواج الکترومغناطیسی تکفام به ذره بارداری که اندازه آن از طول موج تابش خیلی کمتر است برخورد کند، اصولا میدان الکتریکی متغیر سینوسی موج ، بر روی این ذره باردار اثر میگذارد. این ذره تحت تاثیر نیروی الکتریکی متغیر ، با همان فرکانس تابشی ، حرکت نوسانی هماهنگ انجام میدهد و چون بطور پیوسته شتاب میگیرد، در تمام جهات با همان فرکانس تابش الکترومغناطیسی گسیل میکند.

بنابراین نظریه کلاسیک پیشگویی میکند که تابش پراکنده دارای همان فرکانس تابش فرودی خواهد بود. ذره باردار نقش یک عامل انتقال را بازی میکند، زیرا انرژی را از پرتو فرودی میگیرد و مجددا آن را با همان فرکانس ، ولی در تمام جهات پراکنده میکند. نظریه کلاسیک پراکندگی برای تابش با طول موجهای مرئی و همه طول موجهای بلندتر با تجربه توافق دارد.
نظریه کوانتومی پراکندگی امواج الکترومغناطیسی
در نظریه کوانتومی ، تابش الکترومغناطیسی شامل فوتونهایی است که انرژی هر یک با E = hv بیان میشود. چون یک فوتون را میتوان به عنوان یک ذره با جرم سکون صفر ، که با سرعت نور حرکت میکند، در نظر گرفت. بزرگی اندازه حرکت خطی متناظر با این فوتون بر اساس رابطه دوبروی برابر E/c است، که با نتیجه نظریه کلاسیک توافق دارد.هر فوتون در باریکهای از تابش الکترومغناطیسی تکفام با طول موج λ دارای اندازه حرکتی برابر با h/λ میباشد که در آن h ثابت پلانک و λ طول موج منتسب به فوتون است. وقتی که یک باریکه الکترومغناطیسی تکفام را به عنوان مجموعهای متشکل از فوتونهای ذرهگونه ، که هر یک دارای انرژی و اندازه حرکت دقیقا معلوم هستند، در نظر بگیریم عملا پراکندگی تابش الکترومغناطیسی به صورت برخورد فوتون با یک ذره باردار درمیآید.
این مسئله صرفا با بکار بردن قوانین بقای اندازه حرکت و انرژی حل میشود. البته لازم به ذکر است که در کاربرد قوانین بقا ، به جزئیات برهمکنش توجه نمیشود، بلکه فقط به انرژی کل و اندازه حرکت کل قبل و بعد از برخورد پرداخته میشود.
مشخصات اثر کامپتون
- بررسی برخورد کامپتون بین یک فوتون و یک الکترون مبتنی بر این فرض است که الکترون پراکنده باید تقریبا آزاد و ساکن باشد. البته ، هر الکترون موجود در ماده در حرکت است و تا حدی به اتم مادر خویش مقید است، ولی الکترونهای لایههای بیرونی اتم را میتوان عملا آزاد در نظر گرفت (الکترون آزاد) ، چون انرژی بستگی آنها خیلی کمتر از انرژی یک فوتون اشعه ایکس است.
- طول موج فوتونها باید در حد و اندازه ذره پراکننده باشد. بنابراین اثر کامپتونی که در آن فوتون توسط الکترونهای نسبتا آزاد اتم پراکنده میشود، توسط پرتوهای ایکس امکان پذیر است.
- در اثر کامپتون ، برخلاف اثر فوتوالکتریک ، فوتون نابود نمیشود، بلکه فوتون بوسیله الکترون پراکنده میشود. در اینصورت مقداری از اندازه حرکت فوتون به الکترونی که در ابتدا ساکن است، منتقل میشود. بنابراین اندازه حرکت و در نتیجه انرژی فوتون پراکنده کمتر از اندازه حرکت و انرژی فوتون فرودی بوده و الکترون نیز دیگر ساکن نخواهد بود.
- تغییر در طول موج فوتونهای پراکنده شده به وسیله الکترونها از رابطه زیر تبعیت میکند:
در رابطه فوق m0 جرم سکون الکترون ، C سرعت نور ، h ثابت پلانک ، θ زاویه پراکندگی ، λ طول موج فوتون تابشی و λَ طول موج فوتون پراکنده است.
- بر اساس رابطه فوق ، فوتونهایی که تحت زاویه 180 درجه پراکنده میشوند، تغییر طول موجی پیدا نمیکنند. (برخورد شاخ به شاخ)
- رابطه فوق زمانیکه ثابت پلانک به سمت صفر و جرم سکون الکترون به سمت بینهایت میل میکند، به نظریه کلاسیک پراکندگی تحویل میگردد.
فوتون
این تعارض جوهر مانای ذره گونه که با انتشار موج - ذره رخ میدهد، نظریه کوانتوم توصیف عینی یابد، آنگاه میتوانیم موقعیتهای آن را در لحظات پی در پی مشخص و مسیر آن را معین کنیم. اما ذراتی که مسیرهای مشخصی را طی میکنند، مشخصه نقش تداخلی موج گونه آنها را برای هر نوع مادهای که واقعا قابل مشاهده باشد، ایجاد نمیکند. در آزمایشگاه ، این نقشها همچون نقشی از تیک تاکهای آرایهای از آشکار سازها مشاهده میشود. تمهیدات مستند نظریه کوانتومی این نقشها را بوسیله یک تابع موج در فرمالیزم ریاضی آن نظریه بوجود میآورد.
این تابع موج احتمال آشکار سازی یک تیک تاک را توصیف میکند و چشم به راه یک شیء "حقیقی" نیست. بنابراین ، نظریه کوانتومی با نفی اینکه "موج" یا "ذره" "حقیقی" هستند، مسأله موج - ذره را حل میکند. به علاوه ، نظریه کوانتومی با آنچه که از معانی متعارف و رسمی آنها برداشت میشود. مفهوم ماده گاهی موج و گاهی ذره است را ندارد.
بر اساس اصل دوبروی ، در مورد ذرات دو حالت ذرهای و موجی در نظر گرفته میشود، که البته این خاصیت در دنیای میکروسکوپی بیشتر مورد مطالعه است. به عنوان مثال ، اگر ذرهای به جرم یک گرم که با سرعت معمولی در حال حرکت است، در نظر بگیریم طول موج منتسب به این ذره ، چنان کوچک خواهد بود که اصلا قابل ملاحظه نیست. اما در مورد ذراتی مانند الکترون ، این طول موج قابل توجه است. بنابراین با توسل به این اصل میتوان تابش الکترومغناطیسی را نیز متشکل از ذراتی دانست که این ذرات را فوتون میگویند.
واقعیت کوانتومهای نور
نظریه پلانک در ارتباط با بستههای انرژی تابشی ، تا اندازهای مبهم بود و فقط به عنوان مبنایی برای توزیع آماری انرژی میان طول موجهای مختلف در طیف الکترومغناطیسی بکار میرفت. پنج سال بعد از "پلانک" ، "آلبرت انیشتین" توانست این مفهوم را به صورت مشخصتری بیان کند. انیشتین مفهوم کوانتومی نور را برای توجیه اثر فوتوالکتریک بکار برد. بر این اساس ، فوتونها که دارای انرژی معینی هستند، بعد از برخورد با الکترونهای اتم ، انرژی خود را به آنها داده ، خود از بین میروند. این امر میتواند به عنوان یک مسئله برخورد میان دو ذره با استفاده از نظریه برخورد توضیح داده شود.بعد از برخورد ، فوتون از بین میرود و الکترون با انرژیی که از فوتون میگیرد، از ماده جدا میشود و سبب ایجاد یک جریان فوتوالکترونی در مدار خارجی میگردد. مقدار جریان در مدار خارجی ، بسته به تعداد فوتونهایی که بر سطح ماده موجود در کاتد تابیده میشود، متفاوت خواهد بود.
تأییدی دیگر بر وجود فوتون
آزمایش دیگری که توانست وجود فوتونها را بصورت تجربی به اثبات رساند، مربوط به آزمایش است که توسط "کامپتون" انجام شد. این آزمایش که بعدها نام اثر کامپتون را بر خود گرفت، به این صورت بود که تابش الکترومغناطیسی یا فوتونها توسط مواد مختلف پراکنده میشود. به بیان دیگر ، در این آزمایش فوتون بعد از تابش مقداری از انرژی خود را به یک الکترون تقریبا آزاد منتقل میکرد و خود با انرژی کمتر در راستای دیگر منحرف میشد. نتایج این آزمایش که با استفاده از مفهوم کوانتومی نور صورت میگرفت، با نتایج تجربی کاملا تطابق داشت.جرم فوتون
واقعیت جرم فوتون ، به خاصیت عکس مجذوری قانون کولن بر میگردد. بر اساس قانون کولن ، نیروی الکتریکی که دو ذره باردار به یکدیگر وارد میکنند، نیرویی است که با مجذور فاصله بین آنها نسبت معکوس دارد. اما این مطالب در تمام شرایط دقیقا درست نیستند، یعنی در فواصل خیلی کوچکتر انحرافاتی وجود دارد و این نیرو دقیقا عکس مجذوری نیست. در این حالت باید فوتونها را ذراتی دارای جرم بدانیم. اما در موارد دیگر که تقریبا بیشتر موارد را شامل میشود، این نیرو دقیقا عکس مجذوری است. بنابراین در این حالت باید فوتونها را ذراتی بدون جرم تصور کنیم.اتم
این کلمه ، از کلمه یوانانی atomos ، غیر قابل تقسیم ، که از a- ، بمعنی غیر و tomos، بمعنی برش ، ساخته شده است. معمولا به معنای اتمهای شیمیایی یعنی اساسیترین اجزاء مولکولها و مواد ساده میباشد.تاریخچه شناسایی اتم
راجر بوسویچ نظریه خود را بر مبنای مکانیک نیوتنی قرارداد و آنرا در سال 1758 تحت عنوان:
چاپ نمود.
 |
براساس نظریه بوسویچ ، اتمها نقاط بیاسکلتی هستند که بسته به فاصله آنها از یکدیگر ، نیروهای جذب کننده و دفع کننده بر یکدیگر وارد میکنند. جان دالتون از نظریه اتمی برای توضیح چگونگی ترکیب گازها در نسبتهای ساده ، استفاده نمود. در اثر تلاش آمندو آواگادرو (Amendo Avogadro) در قرن 19، دانشمندان توانستند تفاوت میان اتمها و مولکولها را درک نمایند. در عصر مدرن ، اتمها ، بصورت تجربی مشاهده شدند.
اندازه اتم
اتمها ، از طرق ساده ، قابل تفکیک نیستند، اما باور امروزه بر این است که اتم از ذرات کوچکتری تشکیل شده است. قطر یک اتم ، معمولا میان 10pm تا 100pm متفاوت است.ذرات درونی اتم
در آزمایشها مشخص گردید که اتمها نیز خود از ذرات کوچکتری ساخته شدهاند. در مرکز یک هسته کوچک مرکزی مثبت متشکل از ذرات هستهای ( پروتونها و نوترونها ) و بقیه اتم فقط از پوستههای متموج الکترون تشکیل شده است. معمولا اتمهای با تعداد مساوی الکترون و پروتون ، از نظر الکتریکی خنثی هستند.طبقهبندی اتمها
اتمها عموما برحسب عدد اتمی که متناسب با تعداد پروتونهای آن اتم میباشد، طبقهبندی میشوند. برای مثال ، اتم های کربن اتمهایی هستند که دارای شش پروتون میباشند. تمام اتمهای با عدد اتمی مشابه ، دارای خصوصیات فیزیکی متنوع یکسان بوده و واکنش شیمیایی یکسان از خود نشان میدهند. انواع گوناگون اتمها در جدول تناوبی لیست شدهاند.اتمهای دارای عدد اتمی یکسان اما با جرم اتمی متفاوت (بعلت تعداد متفاوت نوترونهای آنها) ، ایزوتوپ نامیده میشوند.
سادهترین اتم
سادهترین اتم ، اتم هیدروژن است که عدد اتمی یک دارد و دارای یک پروتون و یک الکترون میباشد. این اتم در بررسی موضوعات علمی ، خصوصا در اوایل شکلگیری نظریه کوانتوم ، بسیار مورد علاقه بوده است.واکنش شیمیایی اتمها
واکنش شیمیایی اتمها بطور عمدهای وابسته به اثرات متقابل میان الکترونهای آن میباشد. خصوصا الکترونهایی که در خارجیترین لایه اتمی قرار دارند، به نام الکترونهای ظرفیتی ، بیشترین اثر را در واکنشهای شیمیایی نشان میدهند. الکترونهای مرکزی (یعنی آنهایی که در لایه خارجی نیستند) نیز موثر میباشند، ولی بعلت وجود بار مثبت هسته اتمی ، نقش ثانوی دارند.پیوند میان اتمها
اتمها تمایل زیادی به تکمیل لایه الکترونی خارجی خود و (یا تخلیه کامل آن) دارند. لایه خارجی هیدروژن و هلیم جای دو الکترون و در همه اتمهای دیگر طرفیت هشت الکترون را دارند. این عمل با استفاده مشترک از الکترونهای اتمهای مجاور و یا با جدا کردن کامل الکترونها از اتمهای دیگر فراهم میشود. هنگامیکه الکترونها در مشارکت اتمها قرار می گیرند، یک پیوند کووالانسی میان دو اتم تشکیل میگردد. پیوندهای کووالانسی قویترین نوع پیوندهای اتمی میباشند.یون
هنگامیکه بوسیله اتم ، یک یا چند الکترون از یک اتم دیگر جدا میگردد، یونها ایجاد میشوند. یونها اتمهایی هستند که بعلت عدم تساوی تعداد پروتو نها و الکترونها ، دارای بار الکتریکی ویژه میشوند. یونهایی که الکترونها را برمیدارند، آنیون (anion) نامیده شده و بار منفی دارند. اتمی که الکترونها را از دست میدهد کاتیون (cation) نامیده شده و بار مثبت دارد.پیوند یونی
کاتیونها و آنیونها بعلت نیروی کولمبیک (coulombic) میان بارهای مثبت و منفی ، یکدیگر را جذب مینمایند. این جذب پیوند یونی نامیده میشود و از پیوند کووالانسی ضعیفتر است.مرز مابین انواع پیوندها
همانطور که بیان گردید، پیوند کوالانسی در حالتی ایجاد میشود که در آن الکترونها بطور یکسان میان اتمها به اشتراک گذارده میشوند، درحالیکه پیوند یونی در حالی ایجاد میگردد که الکترونها کاملا در انحصار آنیون قرار میگیرند. بجز در موارد محدودی از حالتهای خیلی نادر ، هیچکدام از این توصیفها کاملا دقیق نیست. در بیشتر موارد پیوندهای کووالانسی ، الکترونها بطور نامساوی به اشتراک گذارده میشوند، بطوریکه زمان بیشتری را صرف گردش بدور اتمهای با بار الکتریکی منفیتر میکنند که منجر به ایجاد پیوند کووالانسی با بعضی از خواص یونی میگردد.بطور مشابهی ، در پیوندهای یونی ، الکترونها اغلب در مقاطع کوچکی از زمان بدور اتم با بار الکتریکی مثبتتر میچرخند که باعث ایجاد بعضی از خواص کووالانسی در پیوند یونی میگردد.