اسپین الکترون
میدانیم که کره زمین دارای دو نوع حرکت وضعی و انتقالی است. حرکت انتقالی آن به دور خورشید بوده و حرکت وضعی به دور خودش میباشد. هر یک از این دو نوع حرکت ، دارای اندازه حرکت زاویهای مخصوص به خود هستند که در مورد حرکت انتقالی ، اندازه حرکت زاویهای مداری و در مورد حرکت وضعی ، اندازه حرکت زاویهای اسپینی میگویند، بدیهی است که اندازه حرکت زاویهای کل برابر با مجموع این دو اندازه حرکت است.اگر مدلی را در نظر بگیریم که زمین فقط یک نقطه مادی باشد، انتساب تکانه زاویه ای به آن بیمعنی خواهد بود، اما در مدل دیگری که زمین را با ابعاد محدود در نظر میگیریم، وجود اندازه حرکت زاویهای اسپینی نیز امکان پذیر است. لذا اگر این قضیه را در مورد مدل اتمی بوهر بکار ببریم، با این فرض که الکترون یک بار نقطهای نبوده، بلکه یک کره کوچک فرض شود، در این صورت الکترون علاوه بر اندازه حرکت زاویهای مداری دارای اندازه حرکت زاویهای اسپینی نیز خواهد بود.
تائید تجربی اسپین الکترون
از آن جا که کره مفروض باردار (یعنی الکترون) دارای حرکت است، لذا حرکت چرخشی آن معادل حلقه جریانی است که گشتاور مغناطیسی خاص خود را نیز دارد. اگر واقعا چنین گشتاور مغناطیسیی وجود داشته باشد، باید با میدان برهمکنش داشته و انرژی برهمکنشی نظیر این گشتاور مغناطیسی وجود داشته باشد. این اثرها غیر از برهمکنش گشتاور مغناطیسی مداری با میدان مغناطیسی خارجی است.بنابراین باید جابجایی در ترازهای انرژی اتمها و نیز در طول موج خطوط طیفی که از اتمها گسیل میشود، ظاهر شود که مربوط به اسپین الکترون باشد. در طیف سنج های دقیق چنین جابجائیهایی دیده شدهاند. این نوع آزمایشها و نیز شواهد تجربی دیگر نشان میدهند که الکترون ، تکانه زاویهای و گشتاور مغناطیسی دارد که به حرکت آن بر مدار پیرامون هسته مربوط نبوده، بلکه به ذات ذره مربوط است.
ویژگیهای اندازه حرکت زاویهای اسپینی
تکانه زاویهای یا اندازه حرکت زاویهای اسپینی الکترون را با S نشان میدهند. مانند اندازه حرکت زاویهای مداری ، این کمیت نیز کوانتیده است. بنابراین در میدان مغناطیسی ، S هر جهتی را اختیار نمیکند و فقط مجاز است در جهتهایی قرار گیرد که مولفه آن در امتداد میدان مغناطیسی (اگر میدان مغناطیسی در جهت z فرض شود) ، مضرب 2/1 از ћ باشد. یعنی: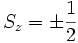
تفاوت بارز مولفه S_z با مولفه z انداه حرکت زاویهای مداری ، در این است که اندازه حرکت زاویهای مداری برخلاف S_z مضرب صحیحی از ћ است.
اسپین الکترون در مکانیک کوانتومی
در مکانیک کوانتومی که تابع موج جانشین مدارهای بوهر میشود، ارائه تصویری از چرخش الکترون غیر ممکن است. اگر توابع موج الکترون را مانند تودههای ابری تصور کنیم که پیرامون هسته قرار گرفتهاند، میتوان تعداد بیشماری پیکان بسیار کوچک را در نظر مجسم کرد که در درون توده ابری پراکندهاند و همگی در یک راستا ، z+ یا z- ، امتداد دارند. البته آنچه گفته شد یک تصور خیالی است و امیدی به دیدن ساختار اتمی وجود ندارد. چون ابعاد آن هزاران مرتبه از طول موجهای نور کوچکتر است. همچنین برهمکنش فوتونها با اتم ، ساختاری را که دیدن آن مورد نظر است، بشدت تغییر میدهد.در هر حال ، مفهوم اسپین الکترون با آزمایشهای متعدد تجربی مورد تائید قرار گرفته است و در مکانیک کوانتومی برای مشخص کردن عدد کوانتومی جدید به نام عدد کوانتومی اسپینی الکترون در نظر گرفته میشود. همان گونه که اشاره کردیم، این عدد کوانتومی فقط میتواند مقادیر pm 1/2 را به خود بگیرد.
ساختار ریز
شکافت تراز انرژی در اثر گشتاور مغناطیسی اسپین الکترون در نبود میدان خارجی را جفت شدگی اسپین مدار مینامند. چون اسپین الکترون با میدان مغناطیسی ناشی از اندازه حرکت زاویهای مداری (حرکت الکترون پیرامون هسته) برهمکنش میکند. در مکانیک کوانتومی با استفاده از حل معادله شرودینگر مقدار این شکافتگی را میتوان تعیین نمود. شکافتگیهایی را که از این نوع برهمکنش مغناطیسی در خطوط طیف مربوط به اتمهای مختلف ایجاد میشوند، در مجموع ساختار ریز میگویند.البته شکافتگیهای به مراتب کوچکتر دیگری نیز وجود دارند که حاصل برهمکنش گشتاور مغناطیسی هسته با تکانه زاویهای مداری و اسپین الکترون هستند و ساختار فوق ریز نام دارد.
اصل طرد پاولی
اصل طرد پاولی بیان میکند که هیچ دو الکترونی ، یا بطور کلی هیچ دو فرمیون مشابهی ، نمیتوانند حالت کوانتومی یکسانی داشته باشند؛ (مثلا بطور همزمان در یک مکان باشند). این اصل برای درک پدیدههای مختلف ، ازذرات بنیادی گرفته تاساختار ستاره ها ، نقش اساسی ایفا میکند. اصلی هست که بنا به آن ، هیچ دو الکترونی در اتم وجود ندارد که مجموعه اعداد کوانتومی آنها مشابه باشد.
در سال 1924، "ادموند استونر" برای اتمها مدلی پیشنهاد کرد که با تجربیات طیف نمایی و جدول تناوبی سازگار بود و در آن ، هر الکترون اتمی سه عدد کوانتومی ، بهترتیب ، متناظر با اعداد کوانتومی و تکانه زاویهای مداری بود. n و l و عدد کوانتومی داخلی ، J+1/2 داشت و تعداد الکترونها در هر پوسته الکترونی برابر با (2S+1) یا دو برابر عدد کوانتومی داخلی بود.
"ولفگانگ پاولی" در سال 1935 نشان داد که ساختار پوستهای کامل ترازهای انرژی را میتوان با تخصیص یک عدد کوانتومی چهارم ، به الکترون ، mj ، که مقادیر مجاز j- و j+1- و ... و j-1 و j را اختیار میکند، توضیح داد؛ اما به شرطی که از اصل طرد جدید پیروی شود. هیچ دو الکترونی نمیتوانند چهار عدد کوانتومی (mj , j , l , n) یکسان داشته باشند. عدد کوانتومی چهارم به تکانه زاویهای ذاتی (اسپین) الکترون نسبت داده میشود که نخستین بار توسط "ژرژ اولنبک" و "ساموئل گوداشمیت" مطرح شد.
اصل طرد پاولی و مدل اتمی بوهر
وقتی که مدل اتمی بوهر با موفقیت ارائه و پذیرفته شد، این پرسش مطرح شد که الکترونها در سیستم سنگین چگونه سازمان پیدا میکنند؟ معادله شرودینگر هیچگونه جواب قانع کننده ای برای این پرسش نداشت. چون مطابق این معادله اگر دمای یک سیستم را به دمای نزدیک به دمای صفر مطلق نزدیک کنیم، آنگاه انتظار میرود که تمام لکترونهای یک اتم به پایینترین سطح انرژی (n=1) منتقل شوند، اما نتایج تجربی طیف شناسها را نمیتوان با این فرض توضیح داد. تا اینکه فردی به نام "ولفگانگ پاولی" توانست این معما را حل کند. وی نظریهای پیشنهاد داد که امروزه این نظریه به اصل طرد پاولی معروف است.مطابق این اصل در یک اتم در حالت پایه ، هیچ دو الکترونی را نمیتوان یافت که هر چهار عدد کوانتمی آنها یکسان باشد. اعداد کوانتمی الکترون ها عبارتند از:
- عدد کوانتمی اصلی که با n نشان داده میشود.
- عدد کوانتمی مداری که با L نشان داده میشود.
- عدد کوانتمی مغناطیسی که با m نشان داده میشود.
- عدد کوانتمی اسپین که با s نشان داده میشود.
شرط برقراری اصل طرد پاولی
در پی ظهور مکانیک موجی در 1926 ، "پاول ویراک" و مستقل از او ، "ورنر هایزنبرگ" نشان دادند که اگر تابع موج سیستمهای الکترونی پاد متقارن باشد، یعنی اگر بر اثر تعویض تمام مختصات هر زوج الکترونی از جمله اسپین آنها تابع موج تغییر علامت بدهد، اصل طرد پاولی خود به خود برقرار خواهد شد. به عبارت کلّیتر ، تابع موج هر سیستمی از ذرات یکسان باید براثر تعویض تمام مختصات هر دو ذرهای یا بدون تغییر بماند که در این صورت ذرات بوزن نامیده میشوند.اسپین بوزون مضرب درستی از ħ/2 است. در صورتی که اسپین فرمیونها مضرب فردی از (ħ/2 و1/2 ħ/2 , 3/2 ħ/2 …) است. فقط فریونها از اصل طرد پاولی پیروی میکنند، در نظریه ، این وابستگی بین اسپین و آمار ذرات را یک واقعیت تجربی تلقی میکنند، در صورتی که در نظریه میدان الکتریکی کوانتومی نیستند، همانطور که پاولی در سال 1940 در اثر معروف قضیه اسپین - آمار خود نشان داد و این وابستگی یک پیامد کلی علیتی بهحساب میآید.
ویژگی اصل طرد پاولی
اصل طرد برخی از بنیادیترین ویژگیهای ماده را در تمامی اشکالش توصیف میکند. اگر به خاطر اصل طرد پاولی نبود، تمام اتمها در اصل ساختار الکترونی یکسانی میداشتند و این ساختار بهصورت پوستهای از الکترونها در اطراف هسته در میآمد. هیدروژن و هلیوم در واقع یک پوسته دارند، اما برای لیتیوم که سه الکترون دارد، وضعیت فرق میکند. دو الکترون اول ، اوربیتال (یا حالت انرژی) یکسانی را با اسپینهای متقابل اشغال میکنند. اما بهعلت اصل طرد پاولی ، الکترون سوم باید به اوربیتال جدیدی برود که بهطور متوسط از هسته دورتر است. به این ترتیب ، بر خلاف هلیوم ، لیتیم براحتی یونیده میشود و در واکنش های شیمیایی شرکت میکند.اصل طرد پاولی در هستهها
در ساختار پوستهای هستهها هم با وضعیت مشابهی رو برو میشویم. چون پروتون و نوترون میتوانند از طریق برهمکنش ضعیف به یکدیگر تبدیل شوند و در همان حال هر دو تحت تأثیر نیروهای هستهای مشابهی قرار دارند به بقیه است که آنها را به عنوان دو حالت از یک نوکلئون که از لحاظ مختصه ذاتی یا عدد کوانتومی دیگری به نام اسپین ایزوتوپی (ایزوسپین) با یکدیگر تفاوت دارند، در نظر بگیریم.در این صورت اصل طرد پاولی ایجاب میکند که هیچ دو نوکلئونی در یک حالت که با اعداد کوانتومی فضایی و اسپینی و ایزوسپینی یکسان مشخص میشود، نباشند. از اصل پاولی میتوان حتی پیامدهای بنیادیتری در سطح زیر هستهای بدست آورد.
یک مثال عملی برای اصل طرد پاولی
به عنوان مثال ، باریونها متشکل از سه کوارک هستند و نتایج آزمایشی حاکی از آن است که ترازهای آنها تابع موجهایی دارند که نسبت به تعویض اعداد کوانتومی فضایی اسپینی و طعم دو کوارک متقارناند. این امر ظاهرا به دلیل آنکه کوارکها فرمیون هستند، با اصل پاولی در تناقض است. اعتقاد راسخ فیزیکدانان به اعتبار عام اصل طرد پاولی ، به فرض و متعاقبا به تأیید یک عدد کوانتومی کوارکی جدید ، به نام رنگ انجامیده است. به این ترتیب ، هیچ دو کوارکی نمیتوانند حالتهایی را که از نظر فضای اسپینی ، طعم و رنگ یکسان باشند، اشغال کنند.اصل طرد پاولی در تراز فرعی
مجموعه تمام حالتهای اشغال شده در هر سیستم بس الکترونی را دریای فرمی و بالاترین تراز اشغال شده در دمای صفر مطلق را انرژی فرمی مینامند. در نظریه فلزات که انرژیهای فرمی نوعا از مرتبه چند الکترون ولت ، یعنی خیلی بیشتر از انرژی میانگین KT = 0.02 ev برای گاز ایدهال در دمای معمولی هستند، از همین تصویر استفاده میشود.چون اصل طرد مانع میشود که تمام الکترونها در پایینترین حالت انرژی تجمع کنند، بعضی از آنها حتی در دماهای بسیار پایین انرژهایی نزدیک به انرژی فرمی ، یعنی انرژیهای متناظر با دماهای چند هزار درجه دارند. بنابراین گرم کردن فلز از T = 0 تا دمای معمولی تأثیر کمی روی توزیع انرژی الکترونها ، تأثیر ناچیزی روی گرمای ویژه فلزات دارند و همچنین چرا فلزات نوعا باید تا حد گداختگی داغ باشند تا الکترونها بتوانند از آنها خارج شوند.
مشخص کردن تراز نوار رسانش توسط اصل طرد پاولی
اصل طرد ، همراه با این نکته که ترازهای انرژی الکترونی جامدات در نوارهای انرژی مشخصی توزیع شدهاند، مبنای نظریه رسانندگی الکتریکی و بسیاری از جنبههای فنآوری جدید است. جامدی که بالاترین نوار اشغال شده آن ، طبق اصل طرد ، کاملا پر شده باشد، یک عابق الکتریکی است. الکترونهای آن بر اثر میدان الکتریکی نمیتوانند آزادانه جریان پیدا کنند. به زبان ساده ، بهعلت اصل پاولی جایی برای رفتن ندارند.از طرف دیگر ، اگر فقط قسمتی از بالاترین نوار اشغال شده پر باشد، جسم جامد رسانای خوبی برای الکتریسیته است. در نیم رساناها گاز بین نوار کاملا پر شده و نوار رسانش مجاز بعدی کوچک ، نوعا در حدود 2ev یا کمتر است. در دمای صفر است که در دمای معمولی بعضی از الکترونها میتوانند از آن عبور کنند و بخشی از نوار رسانش را پر کنند در نتیجه رسانندگی الکتریکی با افزایش دما افزایش مییابد.
اثر فوتوالکتریک
الکترونها میتوانند با جذب تابش به نوار رسانش نیم رسانا صعود کنند. البته با این شرط که انرژی فوتون فرودی از گاف انرژی بیشتر باشد. این اثر فوتوالکتریک ، مبنای خیلی از کاربردها از قبیل در بازکنهای خودکار است که در آنها جریان الکتریکی با تابش نور کنترل میشوند. وقتی که یک الکترون وارد نوار رسانش میشود، در دریای فرمی یک جای خالی یا حفره ، باقی میماند که اشغال آن از نظر اصل پاولی مجاز است.یک الکترون نوار رسانش میتواند به چنین حفرهای منتقل شود و با این کار ، طی فرآیندی که مشابه گسیل فوتون به هنگام پرش الکترون اتمی به حالتی با انرژی پایینتر است، نور تابش میشود. این فرآیند تابشی الکترون و حفره اساس کار دیود نور گسیل (LED) است. و در این فرآیند وقتی که بجای خود به خودی بودن از نوع تحریکی باشد، اساس کار لیزرهای نیم رسانا است. طرز کار ترانزیستورها ، پیوندگاههای دیویدی را هم میتوان با ملاحظات مشابهی ، بر مبنای تولید الکترونهای رسانش در پی آلاییدگی نیم رساناها توضیح داد.
نظریه بوهر
در مورد ساختار اتم ، مدلهای مختلفی ارائه شده است. هر مدل جدیدی که ارائه میگردید، قسمتی از نقایص مدل قبلی را از بین میبرد، ولی با این حال خودش نیز ناقص بود. تقریبا اولین مدل را "تامسون" ارائه داد. تامسون فرض کرده بود که الکترونها در توزیعی از بار مثبت که گستردگی آن را شعاع اتم تعیین میکند، غوطهور هستند. بعد از تامسون ، "رادرفورد" مدل سیارهای خود را ارائه داد.
مدل رادرفورد ، برخی نقایص مدل تامسون را نداشت، ولی در عین حال ناقص بود. بعد از رادفورد ، "بوهر" مدل خود را بر اساس خاصیت کوانتایی تابش بیان کرد.
اصلاح نظریه رادرفورد توسط بوهر
"ارنست رادرفورد" ، نخستین دانشمندی بود که برای مطالعه اتمها از پرتابههایی استفاده کرد که در واپاشی رادیواکتیو گسیل میشدند. رادرفورد یک صفحه طلا را بوسیله ذرات آلفا بمباران کرده و ذرات آلفای پراکنده شده را مورد مطالعه قرار داد. مدل رادرفورد هر چند نتایج حاصل از پراکندگی ذرات آلفا را از لحاظ کمی به خوبی توضیح میداد، ولی با دو مشکل اساسی مواجه بود:- در این مدل فرض میشد که الکترونها حرکت تناوبی دارند، اما طیف تابشی اتمها ساختار هارمونیکی پیشگویی شده را نداشتند.
- مدل رادرفورد فاقد ساز و کاری بود که برای پایداری اتمها لازم است. هر الکترون در مدار دایرهای یا بیضی شکل پیوسته شتاب میگیرد، لذا بر اساس نظریه الکترومغناطیس کلاسیک باید تابش کند. اتلاف دائم انرژی در عرض مدت بسیار کوتاهی به فروریزی اتم میانجامد.
اصل موضوع بوهر
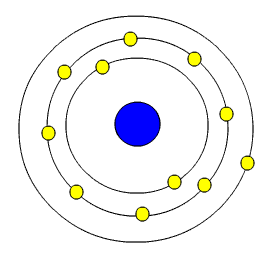
دو سال بعد از این که رادرفورد مدل اتمی خود را ارائه داد، "نیلز بوهر" ، چندین اصل موضوع را بیان کرد که کاملا با فیزیک کلاسیک در تناقض بودند. بوهر ساختار طیفی را بخوبی توضیح داده ، مشکل پایداری اتم را حل میکرد. اصول بوهر عبارتند از:- الکترونها مقید هستند در مدارهایی حرکت کنند که در آنها اندازه حرکت زاویه ای الکترونها مضرب درستی از ħ=frach2π باشد. به عبارت دیگر ، در مورد مدارهای دایرهای شکل با شعاع r ، سرعت الکترون (v) باید از رابطه mvr=nħ تبعیت کند. لازم به ذکر است که الکترونها در این مدارها با وجود شتابی که دارند، تابش نمیکنند. بنابراین مسیرهای حرکت الکترونها را در این مدل ، مدارهای ایستا میگویند.
- الکترونها میتوانند گذارهای گسستهای از یک مدار مجاز به مدار مجاز دیگر انجام دهند. تغییر انرژی این دو تراز به صورت تابشی که فرکانس آن وابسته به تفاضل انرژی این دو تراز است، ظاهر میشود. اگر اتم ، تابش جذب کند، باز الکترونها بر اثر این تابش به یک تراز انرژی بالاتر میروند.
نتایج حاصل از نظریه بوهر
- بر اساس اصول بوهر ، انرژی الکترون در مدارهای اتمی ، کوانتیده خواهد بود. به بیان دیگر ، یک عدد کوانتومی به نام عدد کوانتومی اصلی تعریف میشود که این عدد فقط میتواند عدد صحیح باشد. بنابراین انرژی الکترون در مدار اتمی نمیتواند هر مقداری را به خود بگیرد.
- نیرویی که هسته اتم بر الکترونها وارد میکند، یک نیروی کولنی مرکزگرا میباشد. این نیروی جانب مرکز ، انرژی لازم جهت گردش الکترونها پیرامون هسته را فراهم میکند. بنابراین چون mvr همان اندازه حرکت الکترون در هر مدار اتمی میباشد، بنابراین اصل موضوعه اول بوهر ایجاب میکند که اندازه حرکت زاویه ای الکترون یک کمیت کوانتومی باشد، اصل موضوعه اول بوهر به عنوان شرط کوانتش اندازه حرکت زاویهای میباشد.
نقایص این نظریه
موفقیت نظریه بوهر با اتمهای هیدروژنگونه انگیزه زیادی را برای تحقیقات بیشتر درباره اتم بوهر فراهم آورد. با وجود برخی دستاوردهای شگفتآور بوهر و دیگران ، نظریه بوهر موقتی بود. این نظریه ، درباره این که الکترونها چه هنگامی پرش خود را انجام میدهند، چیزی نمیگفت و قاعده کوانتش به دستگاههای تناوبی منحصر بود.بیان کلیتری از نظریه بوهر را "سامر فیلد" و "ویلسون" عنوان کردند که هیچ کمکی به بررسی مسائل ، غیر از مسائلی که به مدل بوهر مربوط میشد، نکرد. کوانتش اندازه حرکت زاویهای در موارد دیگر نیز برقرار بود. کاربرد مدل بوهر در مدارهای بیضی شکل تصویر کاملتری از اتمهای هیدروژنگونه را بدست میداد و در آزمایشهای اشترن - گرلاخ مستقیما مشاهده شد.