شیمی آلی
واژه غلط انداز " آلی " باقیمانده از روزگاری است که ترکیبهای شیمیایی را ، بسته به این که از چه محلی منشاء گرفته باشند، به دو طبقه غیر آلی و آلی تقسیم میکردند. ترکیبهای غیر آلی ، ترکیبهایی بودند که از مواد معدنی بدست میآمدند. ترکیبات آلی ، ترکیبهایی بودند که از منابع گیاهی یا حیوانی ، یعنی از مواد تولید شده به وسیله ارگانیسمهای زنده بدست میآمدند.در حقیقت تا حدود سال 1950، بسیاری از شیمیدانها تصور میکردند که ترکیبات آلی باید در ارگانیسم های زنده بوجود آیند و در نتیجه ، هرگز نمیتوان آنها را از مواد غیر آلی تهیه کرد. ترکیبهایی که از منابع آلی بدست می آمدند، یک چیز مشترک داشتند: همه آنها دارای عنصر کربن بودند. حتی بعد از آن که روشن شد این ترکیبها الزاما نباید از منابع زنده به دست آیند، بلکه میتوان آنها را در آزمایشگاه نیز تهیه کرد.
بهتر آن دیدند که برای توصیف آنها و ترکیبهایی مانند آنها ، همچنان از واژه آلی استفاده کنند. تقسیم ترکیبها به غیر آلی و آلی تا به امروز همچنان محفوظ مانده است.
منابع مواد آلی
امروزه گرچه هنوز مناسبتر است که بعضی از ترکیبهای کربن را از منابع گیاهی و حیوانی استخراج کنند، ولی بیشتر آنها را میسازند. این ترکیبها را گاهی از اجسام غیر آلی مانند کربناتها و سیانیدها میسازند، ولی اغلب آنها را از سایر ترکیبهای آلی بدست میآورند. دو منبع بزرگ مواد آلی وجود دارد که ترکیبهای آلی ساده از آن بدست میآیند:نفت و زغال سنگ؛ (هر دو منبع به معنی قدیمی خود ، آلیاند، زیرا فرآورده های تجزیه و فساد گیاهان و جانوران به شمار می آیند).
این ترکیبهای ساده بعنوان مواد ساختمانی اولیه مورد استفاده قرار میگیرند و با کمک آنها میتوان ترکیبهایی بزرگتر و پیچیدهتر را تهیه کرد. با نفت و زغال سنگ بعنوان سوختهای فسیلی ، باقیمانده از هزاران سال و تجدید نشدنی ، آشنا هستیم. این منابع ، بویژه نفت ، بمنظور تامین نیازهای پیوسته رو به افزایش ما به انرژی ، با سرعتی نگرانکننده مصرف میشوند.
امروزه ، کمتر از ده درصد نفت مصرفی در تهیه مواد شیمیایی ، بکار گرفته میشود. بیشتر آن برای تامین انرژی بسادگی سوزانده میشود. خوشبختانه ، منابع دیگر انرژی ، مانند خورشیدی ، زمین گرمایی ، باد ، امواج ، جزر و مد ، انرژی هستهای نیز وجود دارد.
زیست توده
چگونه و در کجا میتوانیم منبع دیگری از مواد اولیه آلی پیدا کنیم؛ بی شک باید به جایی روی آوریم که مبدا اولیه سوختهای فسیلی است، یعنی زیست توده biomass ، ولی این بار بطور مستقیم و بدون دخالت هزاران سال. زیست توده ، تجدید شدنی است، براحتی مورد استفاده قرار میگیرد و میتواند تا موقعی که بر روی این سیاره زندگی میکنیم، تداوم داشته باشد.در ضمن عقیده بر این است که نفت خیلی گرانبهاتر از آن است که سوزانده شود.
ویژگی ترکیبات کربن
براستی چه ویژگی خاصی در ترکیبهای کربن وجود دارد که لازم است آنها را از ترکیبهای یکصد و چند عنصر دیگر جدول تناوبی جدا کنیم؟ دست کم ، بخشی از پاسخ چنین است: ترکیبهای بسیار زیادی از کربن وجود دارد و مولکول آنها میتواند بسیار بزرگ و بسیار پیچیده باشد. شمار ترکیبهای کربندار ، چندین برابر ترکیبهایی است که کربن ندارند. این ترکیبهای آلی را به خانواده هایی تقسیم میکنند که معمولا در ترکیبهای غیرآلی ، همانندی برایشان وجود ندارد.بعضی از مولکولهای شناخته شده آلی ، هزاران اتم دارند و آرایش اتمها در مولکولهای نسبتا کوچک ممکن است بسیار پیچیده باشد. یکی از دشواریهای اساسی شیمی آلی ، یافتن چگونگی آرایش اتمها در مولکولها ، یعنی تعیین ساختار این ترکیبهاست.
واکنشها در شیمی آلی
راههای زیادی برای خرد کردن مولکولهای پیچیده یا نوآرایی آنها بمنظور تشکیل مولکولهای تازه وجود دارد. راههای زیادی برای افزودن اتمهای دیگر به این مولکولها یا جانشین کردن اتمهای تازه به جای اتمهای پیشین وجود دارد. بخشی ار شیمی آلی صرف دانستن این مطلب میشود که این واکنشها چه واکنشهایی هستند، چگونه انجام میشوند و چگونه میتوان از آنها در سنتز ترکیبهای مورد نیاز استفاده کرد.گستره اتصال اتمهای کربن در ترکیبات کربن
اتمهای کربن میتوانند به یکدیگر متصل شوند. گستره اتصال آنها به هم ، به اندازهای است که برای اتمهای هیچ یک از عناصر دیگر ممکن نیست. اتمهای کربن میتوانند زنجیرهایی به طول هزارها اتم ، یا حلقههایی با ابعاد گوناگون تشکیل دهند. این زنجیرها ممکن است شاخهدار و دارای پیوندهای عرضی باشند. به اتمهای کربن در این زنجیرها و حلقه ها ، اتمهای دیگری بویژه هیدروژن ، همچنین فلوئور ، کلر ، برم ، ید ، اکسیژن ، نیتروژن ، گوگرد ، فسفر و سایر اتمها متصل میشوند. سلولز ، کلروفیل و اکسی توسین مثالهایی از این دستند.هر آرایش متفاوتی از اتمها با یک ترکیب معین تطبیق میکند و هر ترکیب دارای مجموعه ای از ویژگیهای شیمیایی و فیزیکی مخصوص به خود است. شگفتانگیز نیست که امروزه بیش از ده میلیون ترکیب کربن میشناسیم و این که بر این تعداد ، همه ساله نیم میلیون افزوده میشود. همچنین شگفت انگیز نیست که مطالعه و بررسی شیمی آنها به تخصصی ویژه نیاز دارد.
تکنولوژی و شیمی آلی
شیمی آلی ، زمینهای است که از دیدگاه تکنولوژی اهمیتی فوقالعاده دارد. شیمی آلی شیمی رنگ و دارو ، کاغذ و مرکب ، رنگینه ها و پلاستیکها ، بنزین و لاستیک چرخ است. شیمی آلی ، شیمی غذایی است که میخوریم و لباسی است که میپوشیم.زیست شناسی و شیمی آلی
شیمی آلی در زیست شناسی و پزشکی نقش اساسی برعهده دارد. گذشته از آن ، ارگانیسم های زنده ، بیشتر از ترکیبهای آلی ساخته شده اند. مولکولهای "زیست شناسی مولکولی" همان مولکولهای آلی هستند. زیست شناسی در سطح مولکولی ، همان شیمی آلی است.عصر کربن
اگر بگوییم که در عصر کربن زندگی می کنیم، دور از حقیقت نیست. هر روز ، روزنامهها توجه ما را به ترکیبهای کربن جلب میکنند: کلسترولو چربیهای سیرنشده چند عاملی ، هورمونهای رشد و استروئیدها ، حشره کشها و فرومونها ، عوامل سرطانزا و عوامل شیمیدرمانی ، DNA و ژنها. بر سر نفت ، جنگها در گرفته است.دو فاجعه اسفانگیز ما را تهدید میکنند، هر دو از تجمع ترکیبهای کربن در اتمسفر ناشی میشوند: از بین رفتن لایه اوزون که بیشتر ناشی از کلرو فلوئورو کربنهاست و اثر گلخانهای از متان ، کلروفلوئوروکربنها و بیش از همه ، دیاکسید کربن سرچشمه میگیرد. شاید کنایه بر همین مطلب است که نشریه علوم ، برای سال 1990، بعنوان مولکول سال ، الماس را که یکی از شکلهای آلوتروپی کربن است، برگزیده.
خبر دیگر ، کشف آلوتروپ جدید کربن C60 (باک منیستر فولرن) است که چنین هیجانی در جهان شیمی از زمان " ککوله " تاکنون دیده نشده بود.
آونگ بالستیک
آونگ بالستیک مثالی است که معمولا در تشریع مسایل مربوط به نظریه برخورد مورد استفاده قرار میگیرد. میدانیم که برخورد در حالت کلی میتواند به سه صورت برخورد کشسان یا الاستیک ، برخورد ناکشسان و برخورد کاملا ناکشسان اتفاق بیفتد. در حالت اول قانون بقای انرژی جنبشی برقرار است. بنابراین میتوان از قوانین بقای اندازه حرکت خطی و انرژی جنبشی بهره برد. در صورتی که در برخورد غیر کشسان فقط قانون بقای اندازه حرکت خطی برقرار است. اما در برخورد غیر کشسان کامل که در مسئله آونگ بالستیک نیز این نوع برخورد صورت میگیرد، ذرات برخورد به یکدیگر میچسبند و با هم حرکت میکنند.ساختمان آونگ بالستیک
آونگ بالستیک از یک قطعه چوب بزرگ به شکل مکعب مستطیل تشکیل شده است. این قطعه بوسیله دو تکه ریسمان که به دو سر قطعه چوب متصل شده است، از نقطهای آویزان شده است. گلولهای به طرف این مکعب چوبی تشکیل میشود. بعد ازشلیک گلوله در داخل قطعه چوب فرو رفته و در اثر نیرویی که به آن وارد میکند، موجب نوسان آن میگردد.تشریح حرکت آونگ بالستیک
قطعه چوب به جرم M ابتدا در حالت قائم قرار دارد. حال گلولهای به جرم m و با سرعت افقی Vi به طرف قطعه چوب شلیک میشود. اگر زمان برخورد (زمان لازم برای ساکن شدن گلوله نسبت به قطعه چوب) در مقایسه با زمان نوسان آونگ خیلی کوچک باشد، ریسمانهای نگه دارنده در حین برخورد قائم میمانند. بنابراین ، هیچ نیروی افقی خارجی در حین برخورد، به دستگاه وارد نمیشود، و مولفههای افقی اندازه حرکت خطی پایسته میمانند. سرعت بعد از برخورد سیستم (گلوله + آونگ) خیلی کمتر از سرعت گلوله بعد از برخورد است. این سرعت نهایی که با Vf نشان میدهیم به راحتی با استفاده از قانون بقای اندازه حرکت خطی قابل محاسبه است.بعد از برخورد، آونگ و گلوله به ارتفاع بیشینه Yمیرسند و در آنجا انرژی جنبشی بعد از برخورد به انرژی پتانسیل گرانشی تبدیل میشود. بنابراین قانون بقای انرژی مکانیکی برقرار است، لذا میتوان با اندازه گیری ارتفاع و مخلوط کردن دو رابطه حاصل از قانون بقای اندازه حرکت خطی و قانون بقای انرژی مکانیکی ، سرعت اولیه گلوله را بدست آورد. اصول آونگ بالستیک برای اندازه گیری سرعت گلوله بکار میرود.Vi= (m+M)/m √2gy در این رابطه g شتاب جاذبه زمین است.
پدیده تولید زوج
در تعبیر رابطه معروف اینشتین (E = mc2) اصل هم ارزی جرم و انرژی بیان میشود. به عبارت دیگر ، دو کمیت جرم و انرژی به یکدیگر قابل تبدیل هستند. هرگاه تغییری در جرم حاصل شود، به وسیله تغییر دیگری در انرژی جبران میشود. برای بررسی امکان تبدیل انرژی به جرم میتوان به پدیده تولید زوج اشاره کرد. به عبارت دیگر ، پدیده تولید زوج میتواند به این پرسشها پاسخ دهد که- آیا میتوان از انرژی خالص ماده آفرید؟
- یا اینکه آیا میتوان انرژی سکون را به انرژی الکترومغناطیسی تبدیل کرد؟
البته لازم به ذکر است که در چنین تبدیلاتی باید قوانین بقای انرژی ، اندازه حرکت و بار الکتریکی نقض نشود.
شرایط اولیه تولید زوج
در بین تمام ذرات شناخته شده ، الکترون دارای کوچکترین جرم سکون غیرصفر است و لذا کمترین انرژی برای تولید آن مورد نیاز است. اما میدانیم که فوتون ذرهای بدون بار است، در حالی که الکترون ذرهای باردار است. بنابراین برای اینکه قانون بقای بار الکتریکی نقض نشود، علاوه بر الکترون باید ذره باردار دیگری که بار الکتریکی آن به اندازه بار الکتریکی الکترون با علامت مخالف است، ایجاد شود. این ذره را پوزیترون میگویند که به آن پادذره الکترون نیز گفته میشود.الکترون و پوزیترون به جز از نظر علامت بارها ، از هر نظر دیگری به هم شبیه هستند. بنابراین اگر جرم سکون الکترون و پوزیترون را m_0 بگیریم، کمترین مقدار انرژی فوتون آفرینش یک زوج الکترون و پوزیترون ، با لحاظ کردن قانون بقای انرژی برابر 2m0C2 خواهد بود و چون انرژی سکون الکترون یا پوزیترون با لحاظ کردن مقادیر جرم الکترون و سرعت نور برابر 0،51 میلیون الکترون ولت است، لذا کمترین مقدار انرژی فوتون یا به اصطلاح انرژی آستانه برای تولید باید برابر 1،02 میلیون الکترون ولت باشد. بر این اساس زوجهای الکترون فقط به وسیله فوتونهای اشعه گاما یا فوتونهای اشعه ایکس که طول موج خیلی کوتاهی دارند، قابل تولید است.
تولید زوج با انرژیهای بیشتر از انرژی آستانه
اگر انرژی یک فوتون بیشتر از انرژی آستانه برای تولید زوج الکترون و حفره باشد، مازاد انرژی (یعنی تفاضل انرژی فوتون و انرژی آستانه) به صورت انرژی جنبشی زوج آفریده شده ، ظاهر میشود. این انرژی مجموع انرژی جنبشی الکترون و پوزیترون است.امکان تولید زوج در فضای تهی
میتوان ثابت کرد که در تولید ذره و پادذره انرژی و اندازه حرکت بطور همزمان نمیتوانند پایسته بمانند، مگر اینکه فوتون در نزدیکی ذره سنگینی ، همچون هسته یک اتم باشند. به بیان دیگر ، پدیده تولید زوج در فضای تهی غیرممکن است. به عنوان مثال ، فرض میکنیم که در یک فضای تهی ، فوتون ناپدید شده و یک زوج الکترون و حفره آفریده شود.همچنین فرض کنید که ناظر نسبت به مرکز جرم الکترون و پوزیترون ساکن است. در این صورت اندازه حرکت کل الکترون و پوزیترون نسبت به این ناظر صفر خواهد بود. اما فوتونی که زوج را تولید میکند، در این چارچوب مرجع دارای اندازه حرکت غیر صفر خواهد بود، چون فوتون در هر چارچوب مرجعی همواره با سرعت C حرکت میکند. بنابراین باید قبل از برخورد اندازه حرکت فوتون را داشته باشیم، نه اندازه حرکت خالص بعد از برخورد را. بطور خلاصه ، یک فوتون نمیتواند خودبهخود در فضای تهی به یک زوج الکترون _ پوزیترون واپاشیده شود.
آشکارسازی زوج الکترون و پوزیترون
به دلیل اثرهای یونشی که ذرات باردار هنگام حرکت خود در گاز تولید میکنند، مسیر حرکت آنها قابل روئیت است. حال اگر در این محیط یک میدان مغناطیسی اعمال شود، در این صورت پوزیترون و الکترون به دلیل داشتن بارهای الکتریکی مخالف در قوسهای دایرهای با جهتهای مخالف منحرف میشوند. بنابراین مسیر الکترون و پوزیترون قابل مشاهده خواهد بود.کشف پوزیترون
وجود پوزیترونها در سال 1307 – 1928 توسط دیراک بطور نظری پیشگویی شد. چهار سال بعد اندرسون (C.D. Anderson) در جریان مطالعاتش روی تابش کیهانی ، پوزیترون را مشاهده و مشخص کرد. کمی بعد از آن بوسیله شتابدهندههای ذره که با چند میلیون الکترون ولت کار میکردند، زوجهای الکترون و پوزیترون در آزمایشگاه تولید شدند. امروزه مشاهده زوجهای الکترون و پوزیترون در برهمکنش فوتونهای با انرژی بالا و ماده یک پدیده عادی به شمار میروند. در سالهای 1334 – 1955 برای نخستین بار زوجهای پروتون _ پادپروتون و نوترون _ پادنوترون در آزمایشگاه آفریده شدند.پدیده نابودی زوج
یکی از نتایج اصل هم ارزی جرم و انرژی این است که این دو میتوانند به یکدیگر تبدیل شوند. مشاهده تجربی این مسئله در فرایندهای مختلف مانند اثر فوتوالکتریک ، اثر کامپتون ، پدیده تولید زوج و … انجام شده است. در پدیده تولید زوج تابش الکترومغناطیسی در مجاورت یک هسته سنگین به دو ذره الکترون و پوزیترون واپاشیده میشود، اما پوزیترون نمیتواند طول عمر زیادی داشته باشد، چون فضا پر از الکترون است، لذا پوزیترون بعد از مدت کوتاهی از تولید شدن با یک الکترون ترکیب شده و از بین میرود و به جای آن فوتون یا تابش الکترومغناطیسی ایجاد میشود که به این پدیده نابودی زوج میگویند.شرایط اولیه نابودی زوج
نابودی زوجهای ذره و پادذره و همراه با آن آفرینش فوتونها ، عمل عکس تولید زوج است. نابودی ماده و آفرینش انرژی الکترومغناطیسی را برای حالتی در نظر میگیریم که الکترون و پوزیترون نزدیک به هم و اساسا ساکن باشند. در آغاز اندازه حرکت خطی کل این دو ذره صفر است، بنابراین وقتی این دو ذره به هم میپیوندند و نابود میشوند، یک تک فوتون نمیتواند آفریده شود، زیرا این عمل باعث نقض قانون بقای اندازه حرکت خطی میشود، ولی اگر دو فوتون آفریده شوند که با اندازه حرکتهای مساوی و در جهتهای مخالف حرکت کنند، اندازه حرکت خطی میتواند پایسته بماند.چنین زوج فوتونهایی دارای فرکانسها و انرژیهای یکسان هستند. در واقع میتوان گفت که سه یا چند فوتون میتوانند آفریده شوند، ولی با احتمال به مراتب کمتر از آفرینش دو فوتون. همین طور ، وقتی چندین زوج الکترون و پوزیترون در نزدیکی یک هسته سنگین نابود میشوند، تعداد کمی از این نابودیها یک تک فوتون تولید خواهند کرد.
سرنوشت نهایی پوزیترون
سرنوشت نهایی پوزیترونها بعد از تولید در پدیده تولید زوج ، نابودی است. وقتی که یک پوزیترون با انرژی بالا ظاهر میشود، هنگام عبور از ماده ، در اثر برخوردها ، انرژی جنبشی خود را از دست میدهد و سرانجام با سرعت پایین حرکت میکند. آنگاه این پوزیترون با یک الکترون ترکیب میشود و تشکیل یک دستگاه مقید به نام پوزیترونیوم میدهد که خیلی سریع (در مدت 10^-10 ثانیه) به دو فوتون با انرژی مساوی واپاشیده میشود.از این رو ، مرگ یک پوزیترون با ظهور دو کوانتوم نابودی یا دو فوتون ، که انرژی هریک 0،51 میلیون الکترون ولت است، خبر داده میشود. قابلیت فنا شدن پوزیترونها به دلیل ناپایداری ذاتی نیست، بلکه به خاطر احتمال زیاد برخورد آنها و نابودیهای بعدی با الکترونهاست.
جهان فرضی
در جهانی که ما در آن زندگی میکنیم، کثرت تعداد الکترون ، پروتون و نوترون (در حالت کلی ذره) برقرار است، بنابراین زمانی که پادذرههای این ذرات خلق میشوند، بلافاصله طی فرایندهایی نابود میشوند، اما میتوان فرض کرد که بخشی از جهان وجود دارد که در آن تعداد پوزیترون ، پادپروتون ، پادنوترون (در حالت کلی پادذره) زیاد است. هرچند این امر در حال حاضر فقط در حد یک حدس و گمان است.پیوند پی
اوربیتالهای مولکولی حاصل از ترکیب اوربیتال های اتمی (2P) ، کمی پیچیدهترند. سه اوربیتال (2P) هر اتم ، در امتداد محورهای مختصات دکارتی (X ، Y ، Z ) قرار دارند. اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتمها در امتداد یکی از این محورها مثلا (X) در نظر بگیرییم، دو اوربیتال اتمی (Px) سر به سر به یکدیگر نزدیک میشوند و در نتیجه همپوشانی ، دو اوربیتال مولکولی پیوندی (б 2P) ، و ضد پیوندی б* 2P را به وجود میآورند.تعریف پیوند پی
پیوند کووالانسی که تراکم الکترونی آن در دو ناحیه بالا و پایین محور متصل کننده دو اتم پیوند بیشتر است، پیوند پی (п) نامیده میشود.
اوربیتال پیوندی مولکولی پی (π) و ضد پیوندی پی п*
در تشکیل یک مولکول دو اتمی ، دو اوربیتال اتمی (Pz) از پهلو به هم نزدیک میشوند و دو اوربیتال مولکولی ، یکی اوربیتال پیوندی پی (п) و دیگری اوربیتال مولکولی ضد پیوندی پی п* را به وجود میآورند. اوربیتالهای (п) نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال (п) میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال (п*) ، به هم نگه داشتن مولکول است. اوربیتال п* ، در ناحیه بین دو هسته ، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال п* جدا کردن دو اتم از یکدیگر است. اوربیتالهای اتمی (Py) نیز از پهلو به هم نزدیک میشوند. این دو اوربیتال اتمی نیز یک مجموعه دوتایی اوربیتال مولکولی п و п* به وجود میآورند که نسبت به مجموعه اول عمود است.
انرژی اوربیتالهای п 2P و п* 2P
دو اوربیتال п2P با یکدیگر و دو اوربیتال п* 2P با یکدیگر هم انرژی هستند. بنابراین ، شش اوربیتال مولکولی از دو مجموعه سه تایی 2P به وجود میآید یک اوربیتال σ 2P ، یک اوربیتال σ* 2P ، دو اوربیتال п 2P و دو اوربیتال п* 2P. این شش اوربیتال به همراه دو اوربیتال از دو اوربیتال اتمی 2S ، مجموعا هشت اوربیتال مولکولی را تشکیل میدهند که از اوربیتالهای اتمی n=2 مربوط به دو اتم به دست میآیند.
تعریف انرژی اوربیتال مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و نیز به میزان و نوع همپوشانی اوربیتال های اتمی ، در هنگام تشکیل آن ، بستگی دارد.مقایسه انرژیσ 2P وп 2P
چون میزان همپوشانی اوربیتالهای 2P در تشکیل اوربیتال مولکولی б 2P بیشتر از همپوشانی آنها برای به وجود آوردن اوربیتال مولکولی п 2P است. اوربیتال σ 2P انرژی کمتری از دو اوربیتال مولکولی هم تراز п 2P دارد. اوربیتالهای ضد پیوندی از هر نوع ، نمایند همان قدر افزایش انرژی سیستم است که اوربیتال پیوندی از همان نوع ، از انرژی سیستم میکاهد.نیروی واندروالسی
اولین بار "یوهانس واندروالس" در سال 1873 وجود نیروهای جاذبه بین مولکولی در میان مولکولهای گاز را مطرح کردز به نظر واندروالس مجموع این نیروها هستند که مقدار انحراف یک گاز حقیقی از گاز ایده آل را معین میکنند توضیح منشأ این نیروهای بین مولکولی توسط "فرتینر لاندن" در 1930 پیشنهاد شد. امروزه نیروهای بین مولکولی را بصورت عام نیروهای واندروالس و نیروهای پراکندگی بین مولکولهای غیرقطبی را نیروهای لاندن مینامند.
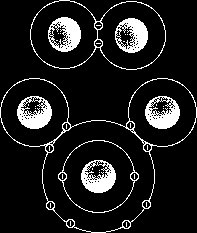
انواع نیروهای واندروالسی
نیروهای دوقطبی - دوقطبی
این نیروها بین مولکولهای قطبی دیده میشوند. این مولکولها دارای دو قطبی های دائمی هستند و تمایل به قرار گرفتن در راستای میدان الکتریکی دارند. پایدارترین حالت زمانی است که قطب مثبت یک مولکول تا حد امکان به قطب منفی مولکول مجاور نزدیک باشد. در این شرایط بین مولکولهای مجاور یک نیروی جاذبه الکتروستاتیکی به نام نیروی دوقطبی بوجود میآید.با توجه به مقادیر الکترونگاتیوی اتمها در یک مولکول دو اتمی میتوان میزان قطبیت مولکول و جهتگیری قطبهای مثبت و منفی را پیش بینی کرد، اما پیش بینی قطبیت مولکولهای چند اتمی باید مبتنی بر شناخت شکل هندسی مولکول و آرایش جفت الکترونهای غیر مشترک باشد.
پیوند هیدروژنی
پیوند هیدروژنی نوعی نیروی بین مولکولی میباشد که در آن ، بین اتم هیدروژن از یک مولکول با اتمهای الکترونگاتیو F و O و N از مولکول دیگر جاذبهای بوجود میآید که به پیوند هیدروژنی معروف است. پیوند هیدروژنی فقط بین ترکیبات دارای H و O و N و F وجود دارد، یعنی در این ترکیبات ، هیدروژن بعنوان پلی بین دو اتم الکترونگاتیو عمل میکند. انرژی لازم برای شکستن یک مول پیوند هیدروژنی از حدود 1 تا 10 کیلوکالری متغیر است.اگرچه پیوندهای هیدروژنی ضعیفتر از پیوندهای کووالانسی میباشد، اما در میان نیروهای بین مولکولی قویترین آنها بشمار میرود. پیوندهای هیدروژنی نقش موثری در ساختار مواد مهم بیولوژیکی شامل پیوندهای N - H و O - H و تعیین خواص آنها دارد. شکل هندسی پروتئینها و نوکلئیک اسیدها که مولکولهای آلی دارای زنجیر بلند هستند با پیوند هیدروژنی میان گروههای N - H یک زنجیر و گروه C = O زنجیر مجاور تثبیت میشود.
نیروهای لاندن (پراکندگی)
مولکولهای غیرقطبی ، دو قطبی دائمی ندارند ولی با وجود این ، تمام مواد غیرقطبی را میتوان مایع کرد. از اینرو ، علاوه بر نیروی دوقطبی - دوقطبی ، باید نوع دیگری از نیروی بین مولکولی وجود داشته باشد. وجود نیروهای پراکندگی در مولکولها بعنوان یک اصل پذیرفته شدهاست. تصور میشود این نیروها ناشی از حرکت الکترونها باشد. در یک لحظه از زمان ، ابر الکترونی یک مولکول بنحوی تغییر شکل میدهد که یک دوقطبی لحظهای بوجود میآید که در آن ، قسمتی از مولکول به مقدار بسیار کم منفیتر از قسمتهای دیگر است و در لحظه بعد ، بعلت حرکت الکترونها جهت دوقطبی لحظهای تغییر میکند.اثر این دوقبیهای لحظهای در طول زمان بسیار کوتاه ، یکدیگر را حذف میکنند، بصورتی که مولکول غیر قطبی فاقد دوقطبی دائمی میشود. ولی دوقطبیهای مواج لحظهای یک مولکول ، دوقطبیهای نظیر خود را در مولکولهای مجاور القا میکنند و حرکت همزمان الکترونهای مولکولهای مجاور باعث ایجاد نیروی جاذبه بین این دو قطبیهای لحظهای ، نیروی لاندن را تشکیل میدهند. نیروی لاندن بین مولکولهای قطبی هم وجود دارد، اما تنها نیروی بین مولکولی موجود در مولکولهای غیرقطبی است.

